ラセミ化しないサリドマイドの開発~フッ素が拓く創薬~
News&Topics
カテゴリ:プレスリリース|2017年8月 1日掲載
- 1950年代に薬害を起こしたくすりサリドマイドは,現在,多発性骨髄腫の重要な治療薬として使われていますが,ラセミ化による催奇形性(胎児に奇形が起こる危険性)の副作用の問題は解決されていません。
- サリドマイドの水素をフッ素に置き換えたフルオロサリドマイドでは,懸念されているラセミ化は起こらず,しかも多発性骨髄腫細胞株の細胞死が増強されることが判明しました。また鏡像異性体間でその生理作用に顕著な差が見られました。
- フルオロサリドマイドはサリドマイドとは違い,血管新生を阻害せず,むしろ若干促進することも判明しました。これらの成果により催奇形性の無い多発性骨髄腫治療薬の開発研究が加速されると期待されます。
研究概要
名古屋工業大学大学院工学研究科の柴田哲男(しばたのりお)教授らは,サリドマイドのラセミ化に起因する水素をフッ素で置き換えたフルオロサリドマイドを開発し,その鏡像異性体に関わる生理活性の詳細をはじめて明らかにすることに成功しました。
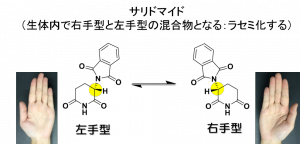
サリドマイドは,1950年代に催眠鎮静薬として販売された医薬品です。しかし,妊婦が服用すると奇形児が生まれるケースが相次ぎ,その使用が中止されました。そのサリドマイドは,現在,多発性骨髄腫の治療薬として再認可されています。ただし問題は,サリドマイドが持つ催奇形性は残ったままであることです。サリドマイドの催奇形性には,サリドマイドの鏡像異性との深い関係が指摘されています。サリドマイドはアミノ酸などと同様に,鏡像異性の関係にある右手型と左手型の分子が存在します。そのうち,左手型サリドマイドのみに催奇形性があると考えられています。そのため,安全な右手型のサリドマイドの使用が不可欠ですが,実際には,サリドマイドは右手型と左手型の混合物として薬物療法に用いられます。これは安全な右手型サリドマイドを服用しても,私たちのからだの中で左手型との混合物に変化してしまうためです。この現象をラセミ化といいます。
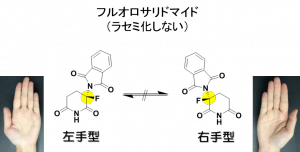
柴田教授らの研究グループは,このラセミ化に関わる水素をフッ素に置き換えたフルオロサリドマイドのラセミ体合成を今から20年近くも前に報告しています。炭素とフッ素の化学結合は水素に比べて強いため,フルオロサリドマイドはラセミ化しません。しかもフッ素は水素に次いで小さな原子で,医薬品分子構造の一つの水素をフッ素に置き換えても,その化学構造に大きな変化はありません。そのため,フルオロサリドマイドの右手型,あるいは左手型を別々に使用することで,サリドマイドが持つ右手型と左手型の生理作用を分離出来ると大いに期待されましたが,フルオロサリドマイドの右手型,左手型の作り別けの煩雑さも加わり,生理作用の詳細は,長い間,不明のままでした。
今回,柴田教授らは,フルオロサリドマイドの右手型および左手型を不斉フッ素化反応にて作り別け,それぞれについて多発性骨髄腫細胞株に対する生理作用の詳細を調べました。不斉フッ素化反応は,狙った位置の右手面,あるいは左手面に選択的にフッ素原子を導入する手法です。選択性発現の鍵は,マラリア治療薬の一つであるキニーネ誘導体を用い,存在させる金属イオン等の違いにより,鏡像異性体の右手型と左手型を容易に作り別けることができるという手法です。フルオロサリドマイドの鏡像異性体を作り別けた結果,右手型,左手型ともに,従来のサリドマイドよりも強い細胞死が見られ,とりわけ右手型のフルオロサリドマイドにもっとも顕著な細胞死誘導があることが分かりました。さらにフルオロサリドマイドはサリドマイドとは正反対に血管新生を阻害することなく,むしろ若干促進することがわかりました。血管新生阻害は,催奇形性と深く関与していると考えられており,この実験結果は,フルオロサリドマイドが催奇形を持たない安全な多発性骨髄腫の治療薬になりうる可能性を示唆します。実際に柴田教授らは,フルオロサリドマイドは催奇形性を示さないという実験結果を別途報告していることから,今回の実験結果は,そのことを裏付ける重要な証拠でもあります。

不斉フッ素化法によるフルオロサリドマイドの鏡像異性体(右手型,左手型)の作り別け
その一方で,右手型,左手型ともに催奇形性を示さない可能性が大いに高まったことから,半田宏教授(東京医科大学)らによって突き止められた,サリドマイドの標的タンパク質であり催奇形性の主要な標的因子であるセレブロンとの結合関係はどのようになっているのかに,強い関心が持たれます。今後,多発性骨髄腫に対する活性発現のメカニズムにまで一層踏み込んだ研究成果が期待されます。
| ラセミ化 | 細胞死誘導 多発性骨髄腫H929 | 腫瘍壊死因子(TNF)α 産生抑制 | 血管 新生 | 催奇形性 | |
|---|---|---|---|---|---|
| サリドマイド |
する |
あり |
あり |
阻害 |
あり |
| フルオロサリドマイド |
しない |
あり |
あり |
促進 |
なし |
|
あり |
あり |
わずかひとつの元素で,サリドマイドの性質をがらりと変えたフッ素。小さくても自己主張の強い元素と呼ばれる所以です。
本研究は,徳永恵津子研究員(名古屋工業大学),秋山秀彦教授(藤田保健衛生大学医療科学部),原 英彰教授(岐阜薬科大学)Vadim A. Soloshonok教授(バスク大学,スペイン)らの協力を得て行ったものです。また、本研究成果は,2017年8月2日午前3時(アメリカ東部標準時間8月1日午後2時)に科学誌「PLOS ONE」のオンライン速報版で公開されます。また、本研究は,独立行政法人 科学技術振興機構「低エネルギー,低環境負荷で持続可能なものづくりのための先導的な物質変換技術の創出 (JST-ACT-C)」,公益財団法人 武田科学振興財団 等の支援を受けて実施しました。
論文情報
論文名:Biological evaluation of both enantiomers of fluoro-thalidomide using human myeloma cell line H929 and others
(多発性骨髄腫細胞株H929等を用いたフルオロサリドマイドの両光学異性体の生物評価)
発表雑誌:PLOS ONE
著者:Etsuko Tokunaga, Hidehiko Akiyama, Vadim A. Soloshonok, Yuki Inoue, Hideaki Hara & Norio Shibata*
URL:https://doi.org/10.1371/journal.pone.0182152
論文詳細は、プレスリリース(PDF)をご覧ください。
お問い合わせ
【内容に関すること】
名古屋工業大学大学院工学研究科
教授 柴田哲男
Tel: 052-735-7543
E-mail: nozshiba[at]nitech.ac.jp
【広報に関すること】
国立大学法人名古屋工業大学 企画広報課 広報室
牧野円香
Tel: 052-735-5322
E-mail: pr[at]adm.nitech.ac.jp
*[at]を@に置換してください。
世界初!白色中性子線を用いて微量な軽元素を含む物質の超精密原子像取得に成功―機能性材料の性能向上に貢献 ― 【2017年4月公開】「熱中症セルフチェック」~熱中症対策を「自分ごとに」~(電気・機械専攻 平田晃正教授)